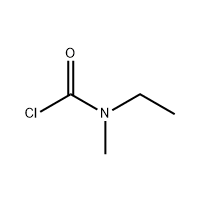
3'-амино-2'-хидрокси-[1,1'-бифени]-3-карбоксилна киселина
3'-амино-2'-хидрокси-[1,1'-бифени]-3-карбоксилна киселина
3'-Амино-2'-хидрокси-[1,1'-бифени]-3-карбоксилна киселина се користи како посредник на Eltrombopag.
Eltrombopag, развиен од GlaxoSmithKline (GSK) во Обединетото Кралство и подоцна заеднички развиен со Novartis во Швајцарија, е првиот и единствен одобрен агонист на мали молекули, непептидни TPO рецептори во светот.Eltrombopag беше одобрен од FDA на САД во 2008 година за третман на идиопатска тромбоцитопенична пурпура (ITP), а во 2014 година за третман на тешка апластична анемија (AA).Тоа е исто така првиот лек одобрен од американската ФДА за третман на АА во последните 30 години.
Во декември 2012 година, американската ФДА го одобри Eltrombopag за третман на тромбоцитопенија кај пациенти со хроничен хепатитис Ц (CHC), така што пациентите со хепатитис Ц со лоша прогноза поради низок број на тромбоцити може да започнат и одржуваат стандардна терапија базирана на интерферон за заболувања на црниот дроб.На 3 февруари 2014 година, GlaxoSmithKline објави дека FDA ја додели квалификацијата за лекови за пробив за третман на Eltrombopag за третман на хемопенија кај пациенти со тешка хемиска книга апластична анемија (SAA) кои не реагирале целосно на имунотерапија.На 24 август 2015 година, американската ФДА го одобри Eltrombopag за третман на тромбоцитопенија кај возрасни и деца на возраст од 1 година и повеќе со хронична имунолошка тромбоцитопенија (ITP) кои имаат недоволен одговор на кортикостероиди, имуноглобулини или спленектомија.На 4 јануари 2018 година, Eltrombopag беше одобрен да се најде на листата во Кина за третман на примарна имунолошка тромбоцитопенија (ITP).


![Избрана слика на 3'-амино-2'-хидрокси-[1,1'-бифени]-3-карбоксилна киселина](http://cdn.globalso.com/jindunchem-med/image351.png)
![3'-амино-2'-хидрокси-[1,1'-бифени]-3-карбоксилна киселина](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-тетра-О-актеил-1-C-[4-хлоро-3-[[4-[[(3S)-тетрахидрофу-ран-3-ил]окси]фенил]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)